יום רביעי, 28 באוקטובר 2009
דוד וולודרסקי - מימן
2. שם היסוד בלועזית : Hydrogen
3. סמל כימי : H
4. התגלה ע"י : המימן זוהה במאה ה- 15 ע"י פרצלסוס. הנרי קבנדיש זיהה אותו שוב ב1766 וחקר את תכונותיו. את שמו המדעי "הידרוגניום" נתן לו לבואזיה ב- 1783
5. התגלה בשנים - 1579-1644
6. מצב צבירה בטמפ' החדר - גז.
7. צבע - חסר צבע.
8. הולכת חשמל - אינו מוליך חשמל.
תכונות נוספות : המימן דליק. קישור לסרטון שמראה שמימן דליק
שימושי המימן כיום : גז המימן משמש לתעשייה, תחבורה, הנעת טילים לחלל ובמעבדות מחקר. גז המימן משמש לשימושים שונים גם בתעשייה כגון יצור אמוניה וכוהל.
מופיע בטבע ושכיחותו בטבע : מימן הוא היסוד הנפוץ ביותר ביקום. מרבית החומר הקיים ביקום הינו מימן הנמצא במגוון כוכבים, בענקי גז ובריכוזים גדולים של גז בין כוכבי שמהווים את השלב הראשון בהתפתחות כוכבים. רוב המימן בגז הבין כוכבי הוא מולקלולרי. מולקולות המימן נוצרות על גרגירי אבק בין-כוכבי.
באטמוספירת כדור הארץ נמצא מימן בריכוזים זעירים (חלקיק אחד מתוך מיליון). המקור הנפוץ ביותר למימן בכדור הארץ הוא מים (H2O). מקורות אחרים הם חומרים אורגניים כמו פחם, גז טבעי ודלקי מאובנים אחרים. מתאן (CH4) הוא מקור חשוב למימן.
תרכובות שכיחות של מימן הן: 1. מים - H2O .2. מי חמצן - H2O2 .3. מי סודה - H2CO3 .4. חומצה גופרתית - H2SO4
טיטניום - רז ביטון
 היסוד טיטניום (Ti) שמספרו הכימי 22 הוא יסוד ממשפחת המתכות.
היסוד טיטניום (Ti) שמספרו הכימי 22 הוא יסוד ממשפחת המתכות.


ברנוב ודים - פלטינה
שם היסוד בלועזית: platinum
סמל כימי: Pt
התגלה על ידי: ג'וליוס סקליגר
התגלה בשנה:1557
מצב צבירה בטמ'פ החדר: מוצק
צבע: לבן אפרפר
הולכת חשמל: כן פלטינה מוליכה חשמל
למה קראו לה ככה: השם פלטינה הוא מהמילה הספרדת פלטינה שתרגומה – כסף, כצבע הפלטינה.
צפיפות הפלטינה:21.5 גר' לליטר.
פעם ראשונה שהתגלה פלטינה בכמויות גדולות:כמויות גדולות ראשונות של פלטינה התגלו רק בשנת 1822, בהרי האורל שברוסיה.
דוגמאות לתרכובת של פלטינה:
פלטינה כלורית (PtCl2) – זוהי אבקה שצבעה חום אפור, המתקבלת כאשר מעבירים כלור מעל פלטינה חמה או כתוצאה מהתפרקות לא מלאה (חלקית) של פלטינה ארבע-כלורית. ניתן להמיס פלטינה כלורית באמצעות חומצת מלח מרוכזת (כאשר חומצת מלח היא חומצה חזקה ביותר!). כמו כן היא נמסה במים ויוצרת תמיסה חומצית חזקה ביותר, כלומר תמיסה שערך ה- PH שלה נמוך ביותר (ככל שערך ה- PH נמוך יותר, החומצה חזקה יותר).
סגסוגת פלטינה אירידיום – זוהי סגסוגת של פלטינה היכולה להכיל עד 30% אירידיום, כאשר ככל שאחוז זה עולה הקשיות והחסינות של סגסוגת זו עולים. לסגסוגת זו שימושים מגוונים: היא משמשת להכנת משקולות מדידה, להכנת מגעים חשמליים, בתעשיית התכשיטים ועוד.
מופיע בטבע:בקרום כדור הארץ מופיע הלפטינה בדרך כלל בעופרת של ניקל ונחושת.
השימושים של הפלטינה: השימושים של הפלטינה הם-
*עשיית תכשיטים יוקרתיים,
*שימושים בכימיה (הפלטינה מסוגלת לזרז תגובות כימיות רבות),
*ברפואה , יצירת כתרים בשיניים וביצור תחליפים לעצמות שניזקו),
*באלקטרוניקה(לייצור מגעים חשמליים),
* ובציוד מעבדה.
שכיחות בטבעה: הפלטינה נימצאת בדרך כלל ב בעופרת של ניקל ונחושת.
מוזכרת בתנ"ך?:הפלטינה אינה מוזכרת בתנ"ך
מידע מעניין:
לפטינה מאוד יקרה והיא יקרה יותר מזהב, הלפטינה היא רעילה, הפלטינה מופיע בטבע
בעיתים נדירות ותרכובת הפלטינה מסוכנת.
הפלטינה היא החומר החשוב ביותר בתעשיית הקטליזטורים הכימיים.
תמונה:

יום שלישי, 27 באוקטובר 2009
רותם - ארגון :)

שימושים של היסוד או תרכובותיו: שימוש נפוץ בארגון הוא מילוי נורות להט, מכיוון שהוא אינו מגיב עם חוט הלהט אפילו בטמפרטורות גבוהות. שימושים נוספים:
ארגון משמש כ"כיסוי" אינרטי בייצור טיטניום ויסודות פעילים אחרים.
כגז מילוי אינרטי בחלל גידול גבישי צורן וגרמניום.
לארגון נוזלי שימוש בפרוצודורות רפואיות כמו למשל חיסול רקמה סרטנית בקור.
בארצות הברית החוקה המקורית שמורה לתצוגה לקהל הרחב במיכל שקוף שמכיל ארגון במקום אוויר, וכך רקבון הנייר נמנע.
עוד קצת על הארגון :
הארגון הוא גז אציל חד אטומי, לא פעיל, חסר צבע וריח. הארגון משמש בתאורה פלואורוסנטית ובריתוך. הארגון "יוצר" סביבת עבודה טובה לחומרים הרגישים לאוויר, מאחר והוא כבד מהאוויר וגם יותר אדיש מהחנקן. מקור השם Argon בלע"ז הוא מהמילה הלטינית Argos שמשמעותה – לא פעיל.
קרן ברמן - אשלגן
מקור השם העברי במרקם היסוד וצבעו הלבן, המזכירים את מרקם השלג.
תרכובת אשלגן קרויה אשלג או פוטאש (Potash). מקור שמו האנגלי של האשלגן (Potassium) במילה Potash.


1. שם היסוד: אשלגן
2. שם היסוד בלועזית: Potassium
3. סמל הכימי: K
4. התגלה ע"י: האמפרי דייווי
5. התגלה בשנים: 1807
6. מצב צבירה בטמפ' החדר: מוצק
7. צבע: לבן-כסוף
8. הולכת חשמל: מוליך (מתכת אלקלית)
אשלגן חנקתי מהווה חומר גלם לייצור אבק שריפה.
אשלגן פחמתי משמש כחומר עזר בייצור זכוכית.
זכוכית שמעובדת עם אשלגן נוזלי חזקה בהרבה מזכוכית רגילה.
NaK - סגסוגת נתרן ואשלגן משמשת כאמצעי מעביר חום.
אשלגן הוא מרכיב הכרחי לצמחים על מנת שיגדלו ונמצא ברוב סוגי האדמות.
באורגניזמים, יוני אשלגן חיוניים לחיי התאים.
מאשלגן, בתוספת חנקן וחמצן, ניתן להפיק אשלגן חנקתי ("סלפטר").
תמונות ...

האשלגן נמצא ב:פירות, מוצרי חלב ועוד.
אבן היסוד של האשלגן.
תהל [: - נאון P:
תעודת זהות לחומר נאון (:
שם : נאון
שם היסוד בלועזית: NEON
צבע : חסר צבע
מצב צבירה בטבע : גז
סמל כימי : 10Ne
מספרו האטומי : 10
צפיפות : 0.8999 kg/m3
טמפרטורות התכה : 24.56K (-248.59°C)
טמפרטורת רתיחה : 27.07K (-246.08°C)

שימושים של היסוד : הנאון משמש לשלטים זוהרים.
התגלה ע"י :
זוהה על ידי ויליאם רמזי ומוריס טרברס (Morris Travers) ב־1898.
החוקרים חיפשו גז כבד לא פעיל, בתערובת הקרה של גזים ונוזלים שנשארו במכונת ההקפאה לאחר שהוציאו מהאוויר הנוזלי את ההליום והארגון. הם מצאו קריפטון. מה שהם לא ידעו שהם קיבלו יחד עם ההליום והארגון גם נאון.
לאחר שמצאו את היסוד הכבד הבא, ולאחר שראו דפוס במשקלים האטומיים, הם היו בטוחים שקיים גז חדש בין הליום וארגון. לכן הם פנו שוב למכונת האוויר הנוזלי שלהם, שיפרו את שיטת ההפרדה ומצאו גז חדש. כאשר העבירו דרך הגז זרם חשמלי הם גילו אור אדום בהיר שאנו מזהים היום עם שלטי הנאון.
שכיחות בטבע :
ליזה-חמרן :)
חמרן (אלומניום )
3. סמל הכימי:Al
4. התגלה ע"י:הנס כריסטיאן אורסטד אולםאולם היוונים והרומאים הקדומים השתמשו באלומינום בתחום הרפואה בתור עוצר דימום.
5. התגלה בשנים:1825
6. מצב צבירה בטמפ' החדר:מוצק
7. צבע:אפור מבריק
8. הולכת חשמל:מוליך
- ברכבים, מטוסים, רכבות, ספינות ואוטובוסים – בשל משקלו הקל של האלומיניום וסגסגותיו הוא נפוץ מאוד בתעשיית כלי תחבורה.
- בכלי בישול – בשל היותו מוליך חום מצוין והקלות שבה ניתן להחזיקו נקי ומבריק האלומיניום משמש כחומר לכלי בישול. אחד הכלים הראשונים שיוצרו מאלומיניום היה קנקן תה ומאז האלומיניום מאד שימושי במטבח.
- מיכלי שתיה (פחיות) – "פחיות שתייה" מיוצרות בימינו מאלומיניום. המכלים אינם מחלידים, משקלן זניח וקל מאד למעוך אותן.
- בבנייה – מסגרות לחלונות ורכיבים רבים נוספים הקשורים לבנייה ולבניין עשויים מאלומיניום.
- בתעשיית הזכוכית – אלומינה (Al2O3),הנמצאת בטבע כאבן אודם, כספיר ובצורות נוספות ומשמשת בעשיית זכוכית. אבני ספיר ואודם סינטטיות משמשות בתהליך הבנייה של הלייזר.
- לריתוך של ברזל או פלדה – כאשר מציתים תרמיט (שהיא תערובת של אבקת אלומיניום וברזל חמצני) עולה להבה עצומה, ומתקבלים חמצן, אלומיניום חמצני וברזל מותך, לכן ניתן להשתמש באלומיניום גם כמרתך.
- כחומר ציפוי למכלי דלק וחלב – מאחר והאלומיניום מחזיר את קרני השמש, הוא מונע את חימום המכלים ותכולתם. לכן מצפים מכליות דלק וחלב באלומיניום.
- כנייר עטיפה – נייר עטיפה, או "נייר כסף", הוא בעצם יריעות דקות של אלומיניום הניתנות לגלילה ולעטיפת מוצרי מזון.
- בקווי חשמל – האלומיניום משמש בקווי חשמל בגלל משקלו הקל ובגלל מחירו הזול יחסית.
- בסגסוגות – כאשר מערבבים אלומיניום עם מתכות אחרות מתקבלת סגסוגת, שהיא יותר חזקה מהאלומיניום עצמו. למשל: אם מוסיפים כמות קטנה של אלומיניום לא נקבל בועות גז כאשר הפלדה תתקשה, ובכך הפלדה תהיה יותר מוצקת.
בן מזור-רדון
2.שם היסוד בלועזית:Radon
3.סמל כימי: Rn
4. מצב צבירה במפרטורת החדר:גז
5.צבע:חסר צבע.
6.לא מוליך חשמל.
7.מופיע בטבע כיסוד
8.השימושים של הפלטינה:מקור הראדון בבניינים הוא מהקרקע המכילה כמויות זעירות של חומרים רדיואקטיביים שבתהליך התפרקותם נוצר הראדון או מהרכב חומרי הבנייה (ובמיוחד מלט).
9.שכיחות בטבע:הרדון נמצא ברוב המקרים בבניינים ובמרתפים.
מידע מעניין:
לאחרונה זכה הגז לתשומת לב ציבורית גבוהה משום הימצאותו בבניינים ובעיקר במרתפים. מקור הראדון בבניינים הוא מהקרקע המכילה כמויות זעירות של חומרים רדיואקטיביים שבתהליך התפרקותם נוצר הראדון או מהרכב חומרי הבנייה (ובמיוחד מלט). יחד עם זאת, פליטת הראדון מקירות איטית והכמות הנפלטת קטנה. בתנאים של אוורור נורמלי כמות זו אינה מהווה סכנה לבריאות. הראדון כגז ובנותיו כאטומים בודדים הנספחים לחלקיקי האבק באוויר, חודרים למערכת הנשימה ומקרינים את רקמות הריאה. ככל שעולה ריכוז הראדון, גדל הסיכוי לחלות בסרטן הריאה. האוכלוסיות הרגישות במיוחד לחשיפה לראדון הם ילדים ואוכלוסיית המעשנים. כ- 50% מהמנה לה אנו נחשפים מקרינה רדיואקטיבית שמקורה בטבע, היא תרומת הראדון.

אמיר סלמוביץ' - בדיל
1. שם היסוד:בדיל
2 . שם היסוד בלועזית:TIN
3. סמל הכימי: SN
4. התגלה ע"י:
5. התגלה בשנים: 3500 לפני הספירה
6. מצב צבירה בטמפ' החדר:מוצק
7. צבע:אפור
8. הולכת חשמל:מוליך
תכונות נוספות(הדגימו בעזרת תמונות, סרטים או אנימציות).
1. מופיע בטבע (כיסוד או כתרכובת או גם כיסוד וגם כתרכובת)מופיע כיסוד , 2 חלקיקי בדיל.
2. שימושים של היסוד או תרכובותיו: הבדיל משמש לציפוי עופרת, אבץ או פלדה למניעת קורוזיה. פלדה מצופה בדיל היא החומר הנפוץ ביותר לייצור קופסאות שימורים לצורך איחסון מזון.
3. שכיחות בטבע (האם מופיע: באטמוספירה, באוקיאנוסים ובימים, בסלעים, בעולם החי?)
כמעט בכל יבשת יש מדינה עם מכרה בדיל חשוב.
4. בטויי לשון הקשורים לשם היסוד.
באנגלית, המילה "Tin" היא ביטוי לכל דבר שמזכיר כסף, בשפת היומית מכנים פחיות שימורים ורדידי אלומיניום בשם "Tin".
5. האם היסוד מוזכר בתנ"ך? אם כן היכן?
הוא לא
6. מידע מעניין הקשור ליסוד (אופי, גילוי, שימושים, תכונות, דרכי הפקה, אזור ההפקה).הדגימו בעזרת תמונות, סרטים או אנימציות. העזרו בטכניקת הטבעת סרטים מתוך ה- youtube

ארבעת המאפיינים הראשונים
שם היסוד בלועזית : Hydrogen
טל מזור - נחושת
2. שם היסוד בלועזית: אנגלית: Copper לטינית: Cuprum
3. סמל הכימי: cu - 29
4. התגלה ע"י:
5. התגלה בשנים: 8700 לפנה"ס
6. מצב צבירה בטמפ' החדר: מוצק
7. צבע: חום-צהוב
8. הולכת חשמל: מוליך
(הדגימו בעזרת תמונות, סרטים או אנימציות).
הנחושת היא מתכת אדמדמה בעלת מוליחות חום ומוליחות חשמלית גבוהות. היא מהמתכות הראשונות אשר שימשו את האדם להכנת כלים ואבזרי קישוט. כיום משמשת הנחושת בעיקר ב תעשיית החשמל והאלקטרוניקה, בשל היותה מוליך חשמל בעל התנגדות נמוכה.
1. מופיע בטבע (כיסוד או כתרכו
 בת או גם כיסוד וגם כתרכובת) - נחושת הוא יסוד היסוד נחושת בנוי
בת או גם כיסוד וגם כתרכובת) - נחושת הוא יסוד היסוד נחושת בנוימולקולות הבנויים מאטומים מולקולת נחושת -

2. שימושים של היסוד או תרכובותיו - היסוד נחושת משמש בעיקר ליצירת כלי מתכת שונים כמו חרבות, כלי נוי כלי נשק שונים כלי מטבח ועוד.חוטי חשמל עשויים מנחושת.צנרת עשויה לעתים מנחושת.ריהוט, כמו למשל ידית לדלת מיוצר לעתים מנחושת.נחושת היא חומר גלם בפיסול, לדוגמה - פסל החירות מכיל 81.3 טון נחושת.ייצור מגנטים.מנועים חשמליים.מתגים חשמליים..אלומיניום נזנח בעבור נחושת בייצור מעגלים מודפסים בזכות ההולכה החשמלית שלה.בבניית אוניות משתמשים בסגסוגת של ניקל ונחושת, בזכות עמידותה לקורוזיה.ישנם מטבעות
העשויים מנחושת.כלי בישול וכלי מטבח מכילים לעתים נחושת.נחושת מהווה תחליף לזיגוג קרמיקה.מנחושת מייצרים כלי נשיפה ממתכת.
3. שכיחות בטבע (האם מופיע: באטמוספירה, באוקיאנוסים ובימים, בסלעים, בעולם החי?) הנחושת נמצאת בסלע ובמקומות רבים בטבע
4. בטויי לשון הקשורים לשם היסוד. לא מצאתי
5. האם היסוד מוזכר בתנ"ך? אם כן היכן? הוא נמצא בכל התנך כמעט פעם על כלי נשק ופעם על כלי נוי העשויים מנחושת
6. מידע מעניין הקשור ליסוד (אופי, גילוי, שימושים, תכונות, דרכי הפקה, אזור ההפקה).
הדגימו בעזרת תמונות, סרטים או אנימציות. העזרו בטכניקת הטבעת סרטים מתוך ה- youtube
נועם -פלואור D:

צבע: צבעו צהבהב(צהוב בהיר) וריחו חריף.

הולכת חשמל:לא.
א. תגובת פלואור עם כמה יסודות שונים:
ב.חלקיקי הפלואור: לפלאור יש 9 אטומים במולקולה.
מצוי בטבע:
פלואור היסוד בעל הערך האלקטרו שליליות הגבוה ביותר מבין כל היסודות.משום כך
זהו היסוד הפעיל ביותר-לכן הוא יכול להגיב עם כמעט כל חומר שהוא ואפילו גזים אציליים.הפלואור מצוי במצב גז בטמפ' החדר ועם זאת הוא אינו מצוי בצורה זו בטבע,משום שהוא היסוד האלקטרושלילי ביותר, ולכן הוא פעיל ביותר ומגיב בקלות עם חומרים אחרים.
לפלואור הרבה שימושים:
- פלואור הוא אחד המרכיבים בתהליך הייצור של טפלון.
- גזים כמו פראון מכילים פלואור (
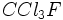 ).
). - עם חומצה פלואורית (
 ) חורטים על זכוכית, כמו למשל על נורה.
) חורטים על זכוכית, כמו למשל על נורה. - תרכובות פלואור-כלור-מימן-פחמן משמשים כנוזלי קירור במזגנים ומקררים. בעשורים האחרונים ישנה מגמה להוציא חומרים אלו משימוש ולעבור לחומרים בטוחים יותר מכיוון שהתגלה שגזים אלו פוגעים בשכבת האוזון.
- נתרן פלואורי שימש בעבר בתור חומר הדברה,בעיקר נגד תיקנים.
- תרכובות פלואור מוספות לעתים קרובות למשחת שיניים,בישראל, ובמקומות אחרים אף מוסיפים פלואוריד למי השתייה.
צליל זכאי - ניקל

קרטריונים ליסוד ניקל:

שם היסוד בלועזית: Nickel
סמל כימי:Ni 28
התגלה ע"י: אקסל פרדריק קרונשטדט.
התגלה בשנים: 3500 לפנה"ס.
מצב צבירה בטמפ' החדר : מוצק.
צבע: לבן-כסוף.
הולכת חשמל: מוליך, ממנו נעשות הסוללות והחומרים בסגנון.
שימושים שונים של הניקל: לניקל שימושים רבים, העיקרי שבהם הוא בסגסוגת. 65% מהניקל שמופק בעולם המערבי משמש להכנת פלדת אל חלד, 12% משמשים להכנת סגסוגות-על ו23% הנותרים משמשים להכנת סוללות נטענות וכימיקלים שימושים.
הניקל הוא עמיד מאוד בפני חמצן.
צורה בטבע:
רוב הניקל שנכרה מגיע משלושה סוגי מחצבים עיקריים, הראשון הוא לימוניט ,השני הוא גרניריט והשלישי הוא פנטלנדיט. מבחינת אספקה, קנדה היא המקור העיקרי לניקל והיא מפיקה כ-30% מהניקל בעולם. המרבץ העיקרי נמצא במקום שבתקופה גיאלוגית מוקדמת של כדור הארץ ספג פגיעות מטאוריטים רבות. מרבצים אחרים נמצאים במקומות אחרים בקנדה וכן ברוסיה, קלדוניה החדשה, אוסטרליה, קובה ואינדונזיה.על סמך ממצאים גיאופיזיים, ליבת כדור הארץ מכילה את רוב אחוזי הניקל.
תפקיד ביולוגי
ניקל הוא יסוד חיוני בתזונת האדם בכמויות זעירות, הוא נמצא בחלבונים ואנזימים מסוימים ומשפיע על תפקודם. מחקרים שנעשו על תרנגולים ועכברים (שקרובים מבחינה גנטית לבני אדם) הראו שניקל חיוני לתפקוד הכבד.
כרום Cr מספר 24 בטבלה המחזורית
היסוד כרום
שם:כרום
מספר האטומי: 24
סמל כימי: Cr
תכונות: כרום הוא מתכת אפורה, מבריקה וחזקה הנמצאת במצב צבירה מוצק בטמפרטורת החדר.
שימושים: בסגסוגות, כרום מעניק עמידות לקורוזיה וגימור סופי מבריק.
כרום הוא אחד המרכיבים של פלדת אל-חלד.
לכרום שימוש בתור חומר ציפוי.
לכרום שימוש באנודיזציה (ציפוי מתכות בעזרת אלקטרוליזה) של אלומיניום והפיכתו לאבן החן אודם.
לכרום שימוש בתור צבען. צבענים ירוקים רבים בשימוש כיום מכילים כרום, כגון ירוק וירדיאן.
לכרום שימושים בתור זרז תהליכים כימיים.
למלחי כרום שימושים בעיבוד עור.
K2Cr2O7 הוא חומר ניקוי לכלי זכוכית במעבדות, יש לו עוד מספר שימושים בתור חומר מחמצן חזק.
צורה בטבע: כרום נכרה כמינרל כרומיט (FeCr2O4) במכרות. הוא מבודד כשמחממים אותו בנוכחות אלומיניום או צורן. מהמכרות בדרום אפריקה מפיקים חצי מכמות הכרום בעולם, יתרת כמות הכרום מקורה בקזחסטן, הודו וטורקיה. בשנת 2000 נכרו 15 מיליון טון FeCr2O4 שמהם הופק 4 מיליון טון כרום בשווי 2.5 מיליארד דולר.
אמצעי זהירות: כרום מתכתי ותרכובות כרום תלת ערכי אינן נחשבות כמזיקות לבריאות. לעומת זאת, תרכובות כרום שש ערכי הן רעילות. חצי כפית של תרכובת כרום שש ערכי רעילה יכולה לגרום למוות. רוב התרכובות של כרום שש ערכי מגרות את העיניים, העור והאף. חשיפה כרונית לכרום שש ערכי יכולה לגרום לנזק קבוע בעיניים ולסרטן.



